Sistem koloid
mempunyai sifat yang khas, yang berbeda dengan sifat sistem dispersi lainnya.
Beberapa sifat koloid yang khas, misalnya efek Tyndall, gerak Brown, adsorpsi,
dan koagulasi.
1. Efek Tyndall
Apa yang dimaksud
dengan efek Tyndall? Simak penjelasannya berikut ini. Seberkas sinar dilewatkan
pada suspensi (dispersi pasir dalam air), koloid (susu), dan larutan (gula
dalam air). Jika dilihat tegak lurus dari arah datangnya cahaya, jejak lintasan
cahaya akan terlihat jelas pada suspensi dan koloid. Akan tetapi, jejak cahaya
pada larutan tidak terlihat. Terlihatnya lintasan cahaya ini disebabkan cahaya
yang melewati suspensi dan koloid dihamburkan oleh partikel-partikelnya,
sedangkan pada larutan tidak terlihat.
Terhamburnya cahaya
oleh partikel koloid disebut dengan efek Tyndall. Partikel koloid dan suspensi
cukup besar untuk dapat menghamburkan sinar, sedangkan partikel-partikel
larutan berukuran sangat kecil sehingga tidak dapat menghamburkan sinar.
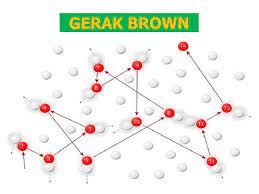
2. Gerak Brown
Jika dispersi koloid
diamaci di bawah mikroskop dengan pembesaran yang tinggi, akan tampak adanya
partikel yang bergerak dengan arah yang acak (tak beraturan). Gerakan-gerakan tersebut
mempunyai lintasan lurus. Gerakan partikel koloid dengan lintasan lurus dan
arah yang acak disebut dengan gerak Brown. Terjadinya gerak Brown
ini diakibatkan adanya tumbukan partikel-partikel pendispersi terhadap partikel
terdispersi sehingga partikel terdispersi akan terlontar. Lontaran tersebut
akan mengakibatkan partikel terdispersi menumbuk partikel terdispersi yang lain
sehingga partikel yang tertumbuk akan terlontar. Kejadian tersebut berulang
secara terus-menerus. Hal ini terjadi akibat ukuran partikel terdispersi yang
relatif besar dibandingkan medium pendispersinya.
Gerak Brown
mengakibatkan partikel-partikel koloid relatif stabil meskipun ukurannya
relatif besar, sebab dengan adanya partikel yang bergerak secara terus-menerus,
dan pengaruh dari gaya gravitasi menjadi kurang berarti.
3. Adsorpsi
Apa yang dimaksud
dengan adsorpsi? Adsorpsi adalah peristiwa penyerapan muatan oleh
permukaan-permukaan partikel koloid. Adsorpsi terjadi karena adanya kemampuan
partikel koloid untuk menarik (ditempeli) oleh partikel-partikel kecil.
Kemampuan menarik ini disebabkan adanya tegangan permukaan koloid yang cukup
tinggi sehingga jika ada partikel yang menempel, akan cenderung dipertahankan
pada permukaannya.
Jika
partikel-partikel koloid mengadsorpsi ion yang bermuatan positif pada
permukaannya, koloid tersebut menjadi bermuatan positif, dan sebaliknya jika
yang diadsorpsi ion bermuatan negatif, koloid akan menjadi bermuatan negatif.
Selain ion,
partikel-partikel koloid dapat menyerap muatan dari listrik statis, misalnya
debu dapat menyerap muatan negatif atau positif dari adanya elektron yang
bergerak di udara atau dari arus listrik.
Peristiwa adsorpsi
menyebabkan partikel koloid bermuatan listrik. Oleh karena itu, jika koloid
diletakkan dalam medan listrik, partikelnya akan bergerak menuju kutub muatan
listrik yang berlawanan dengan muatan koloid tersebut. Peristiwa bergeraknya
partikel koloid dalam medan listrik disebut dengan elektroforesis.
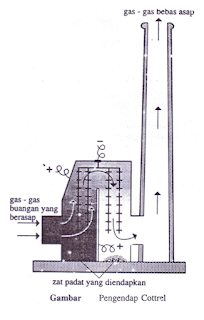
Peristiwa
elektroforesis ini dimanfaatkan dalam proses pemisahan potongan-potongan gen pada
proses bioteknologi dan penyaring debu pabrik pada cerobong asap, yang disebut
dengan pengendap Cottrel.
Koloid-koloid logam
atau basa umumnya mengadsorpsi ion-ion logam pada saat proses pembentukan
koloid sehingga akan menjadi bermuatan positif. As,S, dan kelompok koloid
sulfida lainnya umumnya mengadsorpsi ion negatif sehingga akan menjadi koloid
negatif
4. Koagulasi
Dispersi koloid dapat
mengalami peristiwa penggumpalan atau koagulasi. Peristiwa
koagulasi pada koloid dapat terjadi akibat peristiwa-peristiwa mekanis atau
peristiwa kimia. Peristiwa mekanis misalnya pemanasan atau pendinginan. Darah
merupakan sol butir-butir darah merah yang terdispersi dalam plasma darah. Jika
darah dipanaskan, darah akan menggumpal. Sebaliknya, agar-agar akan menggumpal
jika didinginkan. Peristiwa kimia yang dapat menyebabkan terjadinya koagulasi,
misalnya sebagai berikut.
a. Pencampuran koloid
yang berbeda muatan
Jika sistem koloid
yang berbeda muatan dicampurkan, akan menyebabkan terjadinya koagulasi dan
akhirnya mengendap. Sebagai contoh, sol Fe(OH)3 yang bermuatan positif
akan mengalami koagulasi jika dicampur dengan sol As2S3.
Dengan adanya peristiwa tersebut, jika Anda mempunyai tinta dari merek yang
berbeda di mana yang satu merupakan koloid negatif dan yang lain merupakan
koloid positif, jangan sampai dicampurkan karena dapat mengalami koagulasi.
b. Adanya elektrolit
Jika koloid yang
bermuatan positif dicampurkan dengan suatu larutan elektrolit. ion-ion negatif
dari larutan elektrolit tersebut akan segera ditarik oleh partikel-partikel
koloid positif tersebut. Akibatnya, ukuran koloid menjadi sangat besar dan akan
mengalami koagulasi. Sebaliknya, koloid negatif akan menyerap ion-ion positif
dari suatu larutan elektrolit.
Jadi, ion negatif
akan mengoagulasi koloid positif dan sebaliknya ion positif akan mengoagulasi
koloid negatif. Proses koagulasi semakin mudah jika konsentrasi ion dalam
larutan tersebut semakin besar, dan jika ukuran muatan ion yang berperan dalam
proses koagulasi semakin besar..
Contoh proses
koagulasi dengan penambahan elektrolit dalam kehidupan sehari- hari adalah
penambahan tawas dalam proses penjernihan air. Tawas merupakan garam aluminium
sulfat (Al2(SO4)3) yang di dalam air akan
terionisasi menghasilkan ion Al3+. lon aluminium ini mempunyai
kemampuan untuk menarik molekul-molekul polar termasuk air dan lumpur (koloid)
sehingga terjadi koagulasi. Proses koagulasi menghasilkan partikel yang sangat
besar dan akan mudah mengendap akibat gaya gravitasi. Contoh lainnya adalah terbentuknya
delta di muara sungai akibat lumpur (koloid) yang ada dalam air sungai
berinteraksi dengan air laut yang mengandung ion-ion garam sehingga lumpur
mengalami koagulasi dan mengendap.
Contoh
Sol Fe(OH)3
merupakan koloid positif. Jika diberi elektrolit (misalnya NaCl), yang berperan
mengoagulasi sol Fe(OH)3 adalah ion negatif (ion Cl-).
Semakin besar konsentrasi ion Cl-, semakin cepat proses koagulasi
terjadi. Jika ke dalam sol Fe(OH)3 ditambahkan NaCl dan Na2SO4
dengan konsentrasi yang sama, koagulasi yang lebih cepat terjadi adalah pada
sol Fe(OH)3 yang ditambah larutan Na2SO4,
sebab muatan ion SO42- lebih besar daripada ion Cl-.
5. Kestabilan Koloid
Koloid merupakan
sistem dispersi yang relatif kurang stabil dibandingkan larutan. Suatu produk
industri dalam bentuk koloid umumnya diinginkan dalam kondisi yang stabil,
misalnya krim minyak rambut, krim pembersih muka, bedak cair, dan obat-obatan
yang berupa emulsi. Bagaimana cara menjaga kestabilan koloid? Simak
penjelasannya berikut ini.
a. Menghilangkan
muatan koloid
Koagulasi dapat
dicegah dengan cara menghilangkan muatan dari koloid tersebut. Proses
penghilangan muatan koloid dilakukan dengan proses dialisis. Pada
dasarnya, proses dialisis adalah proses menghilangkan muatan koloid dengan cara
memasukkan koloid ke dalam membran semipermeabel. Membran ini mempunyai
pori-pori yang mampu ditembus oleh ion, tetapi tidak mampu ditembus partikel
koloid. Jika kantong semipermeabel tersebut dimasukkan ke dalam aliran air,
ion-ion yang keluar dari membran semipermeabel akan terbawa aliran air,
sedangkan koloidnya masih tetap di dalam kantung semipermeabel.
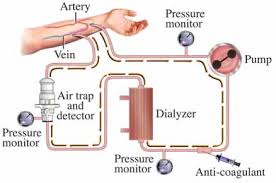
Salah satu
pemanfaatan proses dialisis yang penting adalah proses cuci darah (
hemodialisis).
Pada proses hemodialisis, darah kotor dari pasien dilewatkan dalam pipa-pipa
yang terbuat dari membran semipermeabel. Selama darah berjalan, pipa
semipermeabel tersebut dialiri cairan (biasanya plasma darah) sehingga ion-ion
dalam darah kotor tadi akan terbawa pada aliran plasma darah yang berfungsi sebagai
pencuci.
b. Penambahan
stabilisator koloid
Penambahan suatu zat
ke dalam suatu sistem koloid dapat meningkatkan kestabilan koloid, misalnya
emulgator dan koloid pelindung. Emulgator adalah zat yang
ditambahkan ke dalam suatu emulsi (koloid cair dalam cair atau cair dalam
padat) dengan tujuan menjaga koloid agar tidak mudah terpisah. Sebagai contoh,
penambahan sabun ke dalam campuran minyak dan air serta penambahan amonia dalam
pembuatan emulsi pada kertas film.
Koloid pelindung adalah koloid yang ditambahkan
ke dalam sistem koloid agar menjadi stabil. Sebagai contoh, penambahan gelatin
pada pembuatan es krim agar es krim tidak cepat memisah serta penambahan gum
arab dalam pembuatan semir
6. Koloid Liofil dan
Koloid Liofob
Berdasarkan interaksi
antara partikel terdispersi dengan medium pendispersinya, sistem koloid
dibedakan menjadi dua macam, yaitu koloid liofil dan koloid
liofob. Koloid liofil adalah koloid yang fase terdispersinya suka
menarik medium pendispersinya. Peristiwa ini disebabkan gaya tarik antara
partikel-partikel terdispersi dengan medium pendispersinya kuat.
Koloid liofob adalah
sistem koloid yang fase terdispersinya tidak suka menarik medium
pendispersinya. Jika medium pendispersinya air, koloid liofil disebut juga
sebagai koloid hidrofil, sedangkan koloid liofob disebut sebagai koloid
hidrofob. Perbedaan kemampuan menarik medium pendispersinya mengakibatkan
terjadinya perbedaan sifat-sifat koloid tersebut. Apa saja perbedaannya?
|
No
|
Sifat
|
sol liofil
|
sol liofob
|
|
1
|
Daya adsorpsi
terhadap medium
|
Kuat, mudah
mengadsorpsi mediumnya sehingga ukuran partikelnya dapat semakin besar
|
tidak teradsorpsi
mediumnya
|
|
2
|
Efek Tyndall
|
Kurang jelas
|
sangat jelas
|
|
3
|
Viskositas
(kekentalan)
|
lebih bear dari
mediumnya
|
hampir sama dengan
mediumnya
|
|
4
|
Koagulasi
|
Sukar terkoagulasi
|
Mudah terkoagulasi
(kurang stabil)
|
|
5
|
Lain-lain
|
bersifat reversible
(jika sudah terkoagulasi dapat dengan mudah dijadikan koloid kembali)
|
Bersifat irreversibel
(jika sudah menggumpal sukar diubah menjadi koloid kembali)
|
|
6
|
contoh
|
sabun, detergen,
agar-agar, kanji dan gelatin
|
sol logam, darah,
dan sol Fe(OH)3
|
Bagaimana pemanfaatan
sifat hidrofob dan hidrofil dalam kehidupan sehari-hari? Pemanfaatan sifat
hidrofob dan hidrofil adalah pada penggunaan detergen dalam proses pencucian
pakaian. Kotoran yang menempel pada kain ada yang mudah larut dalam air dan ada
juga yang tidak larut dalam air, misalnya kotoran yang berupa lemak dan minyak.
Proses pencucian
bertujuan agar lemak dan minyak dapat teremulsi di dalam air, tetapi lemak dan
minyak lebih kuat menempel pada kain, sebab lemak dan minyak tidak larut di
dalam air. Dengan bantuan sabun atau detergen, lemak dan minyak akan ditarik
dari serat pakaian dengan mudah. Oleh karena detergen larut dalam air, maka
minyak dan lemak dapat terlepas dari kain.
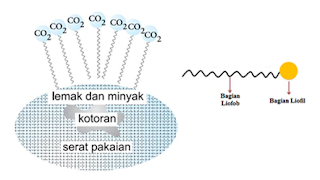
Kemampuan detergen
menarik lemak dan minyak disebabkan pada molekul detergen terdapat ujung-ujung
hidrofil yang menarik air dan ujung hidrofob yang berpegang erat pada lemak dan
minyak. Akibar adanya gaya tarik-menarik tersebut, tegangan permukaan air
menurun sehingga air mudah meresap pada kain. Akibatnya, kotoran yang berupa
lemak dan minyak mudah terlepas dari kain.